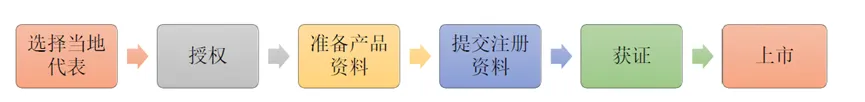
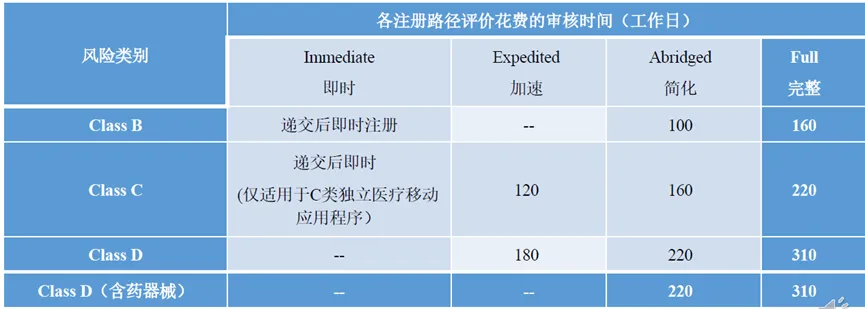
2025全球準入| 新加坡醫療器械注冊要點發表時間:2025-02-10 17:23
   海河生物是一家專業為醫療器械和藥品相關的研究機構、研發和生產企業以及相關監管部門提供產品全生命周期服務的平臺性公司,在生物醫藥CRO領域具有極高的行業地位。海河生物旗下業務涵蓋產品全生命周期服務、服務型制造、智能制造和第三方檢測認證,與我國“十四五規劃”高度契合。 從事醫療器械、藥品、化妝品和生物醫藥環境標準化和定制檢測和監測服務,具有國家級CMA、CNAS、美國ANAB、美國 FDA GLP和OECD GLP,報告認可度廣泛。 向客戶提供中國、美國、歐盟、巴西和加拿大等國家地區的醫療器械、藥品和化妝品全生命周期法規政策咨詢、注冊認證輔導、上市后不良事件處理、技術轉化、培訓等相關服務。 建設有無源耗材、有源設備和體外診斷試劑三條生產線,提供科研成果到最終成品委托開發和加工生產的完整解決方案。 為藥品、醫療器械(尤其是體外診斷試劑)產品提供符合中國、美國和歐盟市場準入的臨床方法驗證確認及檢測服務。
|



